I.Bản Gốc
Slater's Rules:1) Write the electron configuration for the atom using the following design;
(1s)(2s,2p)(3s,3p) (3d) (4s,4p) (4d) (4f) (5s,5p)
2) Any electrons to the right of the electron of interest contributes no shielding. (Approximately correct statement.)
3) All other electrons in the same group as the electron of interest shield to an extent of 0.35 nuclear charge units
4) If the electron of interest is an s or p electron: All electrons with one less value of the principal quantum number shield to an extent of 0.85 units of nuclear charge. All electrons with two less values of the principal quantum number shield to an extent of 1.00 units.
5) If the electron of interest is an d or f electron: All electrons to the left shield to an extent of 1.00 units of nuclear charge.
6) Sum the shielding amounts from steps 2 through 5 and subtract from the nuclear charge value to obtain the effective nuclear charge.
Examples:
Calculate Z* for a valence electron in fluorine.(1s2)(2s2,2p5) Rule 2 does not apply;
0.35 · 6 + 0.85 · 2 = 3.8Z* = 9 – 3.8 = 5.2 for a valence electron.Calculate Z* for a 6s electron in Platinum.
(1s2)(2s2,2p6)(3s2,3p6) (3d10) (4s2,4p6) (4d10) (4f14) (5s2,5p6) (5d8) (6s2)Rule 2 does not apply; 0.35 · 1 + 0.85 · 16 + 60 · 1.00 = 73.95Z* = 78 – 73.95 = 4.15 for a valence electron.
II. Bản dịch và tài liệu khác
-Số lượng tử hiệu dụng kí hiệu là n*
-Điện tích hiệu dụng kí hiệu là Z*(Z* = Z -b)
-Thì năng lượng của elctron sẽ được tính bằng công thức :E=-13,6.(Z*)^2/(n*)^2 (eV)
-Các lơp Gồm: (1s)(2s,2p)(3s,3p) (3d) (4s,4p) (4d) (4f) (5s,5p)
-Qui tắc tính hạng số chắn b
1) Những elctron thuộc các phân lớp nằm phía ngoài electron đang xét thì ko có hiệu ứng chắn , coi như chắn = 0
2) Mỗi điện tử thuộc cùng 1 lớp thì sẽ có số hạng chắn với điện tử khác là b = 0,35 , riêng đối vs nhóm 1s thì số hạng chắn này là 0,3
3) Nếu electron đag xét nằm ở obitan s hay p thì mỗi điện tử ở các phân lớp trong (n'=n-1) sẽ góp 1 hằng số chắn b = 0,85 . Nếu sâu hơn nữa thì sẽ có số hạng góp là 1 .
4) Nếu điện tử đag xét nằm trên obitan d hay f thì mỗi điện tử những nhóm bên trong (ngay cả khi cùng lớp n ) sẽ có hằng số chắn là b = 1 .
Quy tắc Slater được viết theo dạng bảng:
| Nhóm | Các điện tử khác, nằm trong cùng nhóm | Các điện tử nằm trong nhóm có số lượng tử chính n và số lượng tử xung lượng nhỏ hơn l | Các điện tử nằm trong nhóm cósố lượng tử chính (n-1) | Các điện tử nằm trong nhóm có số lượng tử chính nhỏ hơn (n-1) |
|---|---|---|---|---|
| [1s] | 0,3 | Không có | Không có | Không có |
| [ns,np] | 0,35 | Không có | 0,85 | 1 |
| [nd] or [nf] | 0,35 | 1 | 1 | 1 |
* Ví Dụ
Tính điện tích hạt nhân hữu hiệu và hằng số che lấp của các điện tử trong nguyên tử sắt với điện tích hạt nhân là 26 và cấu hình điện tử là 1s22s22p63s23p63d64s2[1]
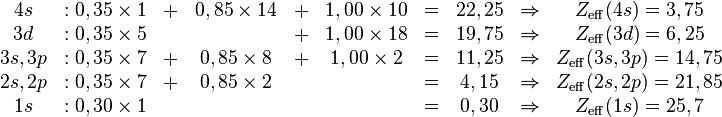
- *
-
cung cấp một phương pháp xác định gần đúng cho hàm sóng của một điện tử đơn lẻ. Slater định nghĩa n* theo quy tắc nếu n = 1, 2, 3, 4, 5, 6 thì lần lượt n* = 1, 2, 3, 3.7, 4.0 và 4.2. Đó là một sự tùy chỉnh nhằm mục đích làm mức năng lượng nguyên tử có được sau tính toán ăn khớp với các kết quả thực nghiệm.
Mục đích
Quy tắc này được Slater phát triển nhằm xây dựng nên một biểu thức phân tích đơn giản cho obitan nguyên tử của các electron trong nguyên tử. Cụ thể hơn, đối với mỗi electron trong nguyên tử, Slater muốn xác định hằng số che lấp (s) và số lượng tử "hữu hiệu" (n*) tỉ như









Post a Comment